Stéréochimie...
Les
réactions chimiques, qui impliquent une approche des réactifs
et l'établissement d'un état de transition, ont lieu dans un
espace à trois dimensions.
De plus les molécules dont nous examinons la structure ne sont pas
complètement définies par une formule plane; il est indispensable
de spécifier la position relative des atomes les uns par rapport aux
autres.
En fait, stéréochimie et chimie sont indissociables.
En effet, la chimie dite «sur papier», à deux dimensions,
ne fait intervenir que les formules brutes ou les formules planes et elle
se révèle totalement insuffisante dès qu'un phénomène
chimique (mécanisme réactionnel par exemple) est examiné
dans le détail.
Les modèles moléculaires et leur représentation symbolique
plane sont une aide précieuse pour le chimiste, qui peut prévoir
les isoméries et interpréter des réactions.
La stéréochimie met donc l'accent sur l'aspect stérique
de la chimie, et des informations précieuses sont obtenues en examinant
une réaction, si simple soit-elle, sous l'angle de sa stéréochimie.
1-INTRODUCTION
:
Un atome est tertiaire s’il
est relié à 3 atomes de carbone C.
Il peut également être secondaire, primaire ou nullaire même
si ce terme n'est quasiment pas utilisé.
Dans la molécule de 3-méthylbutan-1-ol on trouve par exemple un atome de carbone C tertiaire, un atome C secondaire, et trois atomes C primaire (dont le carbone fonctionnel) :
![]()
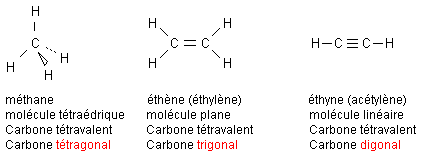
Un atome de carbone possède 4 électrons externes. Pour satisfaire à la règle de l'octet il échangera 4 liaisons avec ses voisins, il est tétravalent
Un atome de carbone est tétragonal, trigonal, digonal selon qu’il est relié à 4, 3 ou 2 atomes voisins
Un
atome d’oxygène ![]() possède
6 électrons externes. Pour satisfaire à la règle de l'octet
il échangera 2 liaisons avec ses voisins, il est divalent
possède
6 électrons externes. Pour satisfaire à la règle de l'octet
il échangera 2 liaisons avec ses voisins, il est divalent
Un
atome d’azote ![]() possède
5 électrons externes. Pour satisfaire à la règle de l'octet
il échangera 3 liaisons avec ses voisins, il est trivalent (sauf dans
l’ion ammonium NH4+).
possède
5 électrons externes. Pour satisfaire à la règle de l'octet
il échangera 3 liaisons avec ses voisins, il est trivalent (sauf dans
l’ion ammonium NH4+).
2- ISOMERES DE CONSTITUTION ET STEREOISOMERES (Isomères spatiaux)
Formule
brute - Formule plane - Formule semi-développée plane
La formule brute de l’acide 2-méthylpropanoïque est : C4H8O2.
Sa
formule développée plane est :
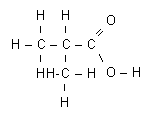
Sa formule semi-développée plane est
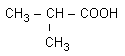
Précisons que seule la formule dans l'espace à trois dimensions (voir ci-dessous) est proche de la réalité.
· Définition : Deux isomères sont deux composés qui ont la même formule brute mais dont les molécules sont différentes. Les molécules de deux isomères ne sont pas superposables.
On distinguera l'isomérie de constitution et la stéréoisomérie (voir ci-dessous).
· Isomérie de constitution.
Deux
isomères de constitution ont même formule brute mais des formules
semi-développées planes différentes
Exemple :
| C3H8O | Propan -1 - ol | CH3 - CH2 - CH2OH |
| C3H8O | Propan - 2 - ol | CH3 - CHOH - CH3 |
·
Stéréoisomérie
Lorsqu'on
considère une molécule dans l'espace à trois dimensions,
de nouveaux cas d'isomérie peuvent apparaître.
On parle alors d'isomérie spatiale ou de stéréoisomérie
(du grec stéréos : solide)
Deux stéréoisomères ont la même formule semi-développée plane mais des formules différentes dans l’espace à trois dimensions.
On étudiera :
a- La stéréoisomérie de configuration qui comprend deux types :
- la stéréoisomérie optique ou énantiomérie
- la stéréoisomères de configuration Z / E
b- La stéréoisomérie de conformation
3- STEREOISOMERES DE CONFIGURATION
3-1 Stéréoisomères de configuration de type optique -
Enantiomérie
Définition : une molécule est chirale si elle n’est pas superposable à son image dans un miroir. C’est le cas, notamment, d’une molécule possédant un atome de carbone asymétrique (un atome de carbone asymétrique est un atome de carbone lié à 4 atomes ou groupes d'atomes différents).
Les 2 stéréoisomères, images non superposables, sont appelés énantiomères.
Il existe aussi d'autres cas que nous n'approdondirons pas ici.
Exemple :
La molécule de butan-2-ol possède un atome de carbone asymétrique. Elle est donc chirale et admet deux stéréoisomères de configuration appelés énantiomères (ou isomères optiques). Ces énantiomères sont images l’un de l’autre dans un miroir et non superposables. Une propriété optique (pouvoir rotatoire) permet de les distinguer.

Pour passer d’une configuration à une autre il faudrait rompre des liaisons, ce qui demanderait beaucoup d’énergie. A température ordinaire, l’agitation thermique ne suffit pas. On peut donc séparer les deux types de molécules.
L'isomérie optique joue un rôle important dans beaucoup de mécanismes biochimiques (une molécule ne peut pas réagir à la place de son isomère optique).
Deux
énantiomères de même concentration traversés par
un trajet de même nature font tourner en sens inverse mais d'un même
angle le plan de polarisation d'une lumière polarisée plane.
Cette propriété permet de différencier les deux enantiomères
d'une molécule chirale.
L'énantiomère lévogyre (ex: fructose) dévie le
plan de la lumière polarisée vers la gauche et l'énantiomère
dextrogyre (ex: glucose) le dévie vers la droite (c'est à dire
Rectus ou Sinister) (allez voir Plan
de polarisation, pouvoir rotatoire...)
L'ion N-éthyl N-méthyl propylammonium est, lui aussi chiral. Il possède un atome d'azote asymétrique.
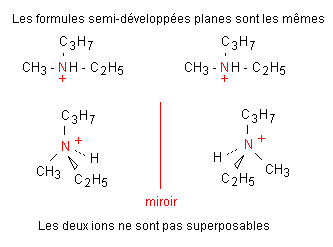
3-2 Stéréoisomères de configuration Z / E
Le but-2-ène CH3 - CH = CH - CH3 possède 2 stéréoisomères non superposables :

4- STEREOISOMERES DE CONFORMATION
4-1
Cas de l'éthane
Considérons un modèle éclaté de la molécule d'éthane et effectuons une projection de Newman :
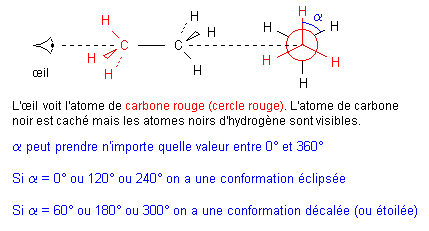
Prenons comme solide de référence le groupe méthyle rouge et faisons tourner par rapport à ce référentiel le groupe méthyle noir autour de l'axe C - C. La molécule passe par une infinité de structures appelées conformations (alpha varie ente 0° et 360°). Passer d'une conformation à une autre se fait sans rompre de liaisons.
La rotation d'un groupe méthyle par rapport à l'autre autour de la liaison simple C - C est possible car elle ne demande pas beaucoup d’énergie. Les chocs dus à l’agitation thermique à température ordinaire suffisent. Il est donc impossible de séparer des isomères de conformation car la même molécule se présente successivement sous une infinité de conformations.
Aspect énergétique : Entre les doublets liants (chargés d'électricité négative) existent des actions répulsives. A l'intérieur du groupe méthyle -CH3, ces répulsions donnent une disposition tétragonale. Entre les deux groupes -CH3 ces interactions électriques sont minimales dans les conformations décalées et maximales dans les conformations éclipsées.
Au cours de la rotation d'un groupe méthyle par rapport à l'autre, l'énergie de la molécule d'éthane varie. Cette énergie est minimale dans les conformations décalées et maximale dans les conformations éclipsées. Par conséquent la conformation décalée est la plus stable et donc la plus probable.
4-2 Cas du butane
Le butane CH3 - CH2 - CH2 - CH3 possède trois liaisons simples C - C et présente une infinité de conformations résultant de la rotation possible des divers groupes les uns par rapport aux autres autour de chacune de ces liaisons simples. Parmi celles-ci, les plus intéressantes à étudier sont celles que l'on observe par rotation autour de la liaison simple existant entre les carbones Cbeta et Cgamma (les 4 atomes de carbone sont repérés par les lettres alpha, beta, gamma, delta).
- La projection de Newman montre que les conformations éclipsées, qui étaient identiques pour l'éthane sont, ici, différentes.
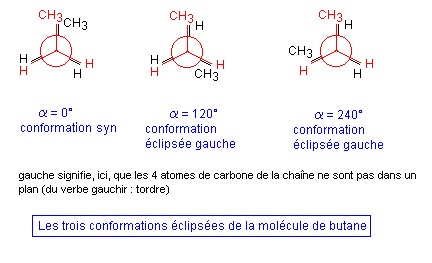
- De même les trois conformations décalées sont, ici, différentes (elles étaient identiques dans le cas de l'éthane).
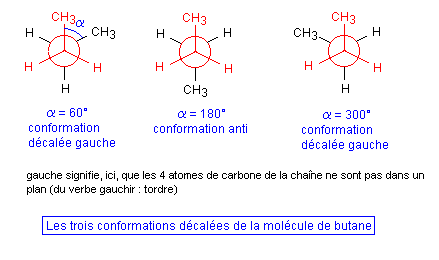
Aspect énergétique : D'un point de vue énergétique on sait que les conformations les plus stables sont les conformations décalées, la plus stable de toutes étant la conformation anti (alpha = 180°). C'est celle dont l'énergie est minimale (les deux groupes méthyle -CH3 sont le plus loin possible).
Les conformations éclipsées sont d'énergie supérieure. La conformation la moins stable étant celle pour laquelle alpha = 0° (conformation syn).
Remarque : On appelle conformères les conformations les plus stables d'une molécule. On dira donc que le butane possède trois conformères : le conformère anti et les deux conformères décalées gauches.
Rappelons que toutes les valeurs de a sont néanmoins possibles puisque par simple agitation thermique on peut passer d'une conformation à une autre. Ceci n'était pas le cas lorsque précédemment on parlait des configurations Z et E du but-2-ène ou des deux configurations optiques du butan-2-ol.
5- COMPARAISONS ENTRE CONFIGURATIONS ET CONFORMATIONS
Pour passer d'une configuration à une autre il faut rompre (et reformer) certaines liaisons. Deux configurations sont séparées par une barrière énergétique importante et sont isolables.
On peut passer d'une conformation à une autre sans rompre de liaisons. Les barrières énergétiques qui séparent l'infinité de conformations sont faibles; il est impossible de les séparer dans les conditions habituelles. Les chocs dus à l'agitation thermique à la température ordinaire suffisent pour faire passer une molécule d'une conformation à une autre.